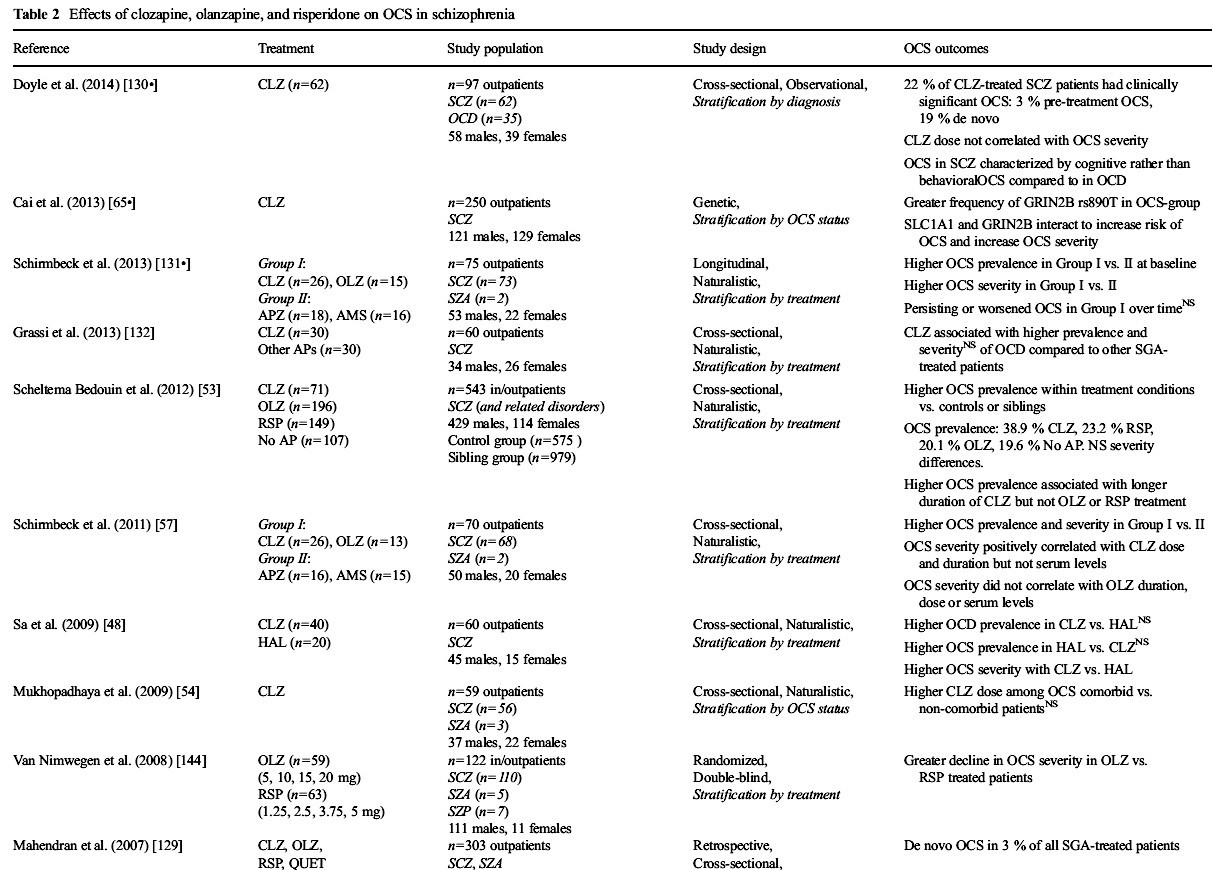
Résumé
Les antipsychotiques de seconde génération (AP2G / SGA) ont joué un rôle dans la survenue et l’exacerbation de symptômes obsessionnels-compulsifs (SOC/OCS) chez des patients avec schizophrénie. Parmi les AP2G, la clozapine l’olanzapine et la risperidone sont les agents les plus liés à ces séquelles, d’après les études de cas. Les SOC comorbides peuvent empêcher le rétablissement en compromettant les bénéfices du traitement, l’observance des posologies, et le pronostic clinique. Les revues précédentes des SOC induits par les antipsychotiques se sont essentiellement intéressées à des études de cas, avec une attention limitée aux découvertes expérimentales. Pour combler ce manque de données, nous avons cherché à passer en revue les effets des AP2G sur les SOC dans la littérature relative aux essais en schizophrénie, tout en relevant le rôle des différents traitements (en durée, dose, concentration sérique) et les aspects pharmacocinétiques. Nos découvertes suggèrent que la clozapine a le plus de risque de SOCs dans la schizophrénie, avec 20 à 28 % des patients traités développant des SOCs non préexistants, plus 10 à 18 % connaissant une aggravation de SOC préexistants. La clozapine peut aussi provoquer un véritable trouble obsessionnel-compulsif (TOC/OCD) dans certains cas. L’olanzapine est un autre psychotrope à risque élevé pour les SOC secondaires qui surviennent pour 11 à 20 % des patients traités à l’olanzapine. A ce jour il n’y a pas suffisamment de données de preuve sur les autres AP2G concernant les SOC. Malgré des faits expérimentaux sur le rôle d’un traitement à long terme et les facteurs génétiques de survenue des SOC induits par les psychotropes, d’autres recherches sont nécessaires pour élucider clairement ces liens. Sur la base de ces résultats, les patients schizophréniques devraient faire l’objet d’une surveillance généralisée des SOC au cours du traitement aux AP2G, en particulier sous clozapine ou olanzapine.
Introduction
La schizophrénie est un trouble psychiatrique très invalidant, caractérisé par une évolution chronique, et suivant les systèmes de diagnostic utilisés, a une prévalence sur la vie de l’ordre de 1 à 4 cas pour 1000 personnes (1 2 3). L’amélioration clinique des symptômes schizophréniques est principalement obtenue par le traitement médicamenteux antipsychotique. A la différence des antipsychotiques de première génération (AP1G/FGAs), il a été montré que la seconde génération d’antipsychotiques (AP2G/SGAs) induit des symptômes obsessionnels-compulsifs (SOC/OCS) chez les patients schizophréniques, malgré leur efficacité clinique relativement supérieure. Dans les faits, les cas relevés impliquent plus souvent la clozapine, l’olanzapine et la rispéridone comme agents des SOCs secondaires (4), qui sont phénoménologiquement similaires aux SOC du Trouble obsessionnel compulsif primaire. (5) Toutefois, l’examen des SOCs induits par les AP3G dans la littérature est insuffisant, car les revues précédentes se sont essentiellement penchées sur les résultats d’études descriptives auxquelles manquent les paramètres scientifiques pour distinguer clairement les effets spécifiques du traitement. La caractérisation de ce phénotype induit par les psychotropes est cliniquement pertinente dans le sens où elle peut s’appliquer à la pratique clinique et à des stratégies de traitement efficaces. Ainsi, cette revue résumera les découvertes des essais qui examinent l’effet des AP2G sur la prévalence et la sévérité des SOCs chez les patients schizophréniques, en étudiant le rôle du traitement (durée, dose, concentration sérique) et des facteurs pharmacogénétiques comme facteurs potentiels.
2. Jablensky A. Epidemiology of schizophrenia: the global burden of disease and disability. Eur Arch Psychiatry Clin Neurosci. 2000;250(6):274–85.
3. Bhugra D. The global prevalence of schizophrenia. PLoS Med. 2005;2(5):e151. oi:10.1371/journal.pmed.0020151. quiz e75.
4. Lykouras L, Alevizos B, Michalopoulou P, Rabavilas A. Obsessive-compulsive symptoms induced by atypical
antipsychotics. A review of the reported cases. Prog Neuro-Psychopharmacol Biol Psychiatry. 003;27(3):333–46. doi:10.1016/S0278-5846(03)00039-3.
5. Kim JH, Ryu S, Nam HJ, Lim M, Baek JH, Joo YH, et al. Symptom structure of antipsychotic-induced obsessive compulsive symptoms in schizophrenia patients. Prog Neuro-Psychopharmacol Biol Psychiatry. 2012;39(1):75–9. doi:10.1016/j.pnpbp.2012.05.011.
Méthodes
Pour évaluer les effets des AP2G dans l’induction et l’exacerbation de SOC dans la schizophrénie, une recherche de littérature dans les bases de données OVID Medline, Embase et PsycINFO a été réalisée. Les termes recherchés étaient (‘schizophrénia’ OU ‘psychosis’ OU ‘psychotic’) ET (‘obsessive compulsive disorder’ OU ‘OCD’ ou ‘obsession’ OU ‘compulsion’) ET (‘atypical antipsychotic’ OU ‘neuroleptic drug’ OU ‘second generation antipsychotic’ OU ‘clozapine’ OU ‘risperidone’ OU ‘quetiapine’). Les résultats ont été restreints aux articles relatant des essais, revus par des pairs, et publiés en anglais entre 1960 et 2014. Les études concernant les méthodes précliniques ou de méthodologie descriptive ont été exclues. Aucune restriction secondaire démographique (p. ex : âge, sexe, ethnicité) ou clinique (p. ex : sévérité des symptômes, comorbidités ou état médical) portant sur les patients, et aucune variable dans la conception des études (p. ex la taille, la méthode d’évaluation, la dose ou la durée du traitement) n’a été appliquée. La recherche a trouvé 127 articles qui furent examinés individuellement pour vérifier qu’ils satisfaisaient aux critères de recherche.
Un total de 15 études ont été sélectionnées pour l’examen des SOCs induits par la clozapine, 9 pour les SOCs induits par l’olanzapine, et 6 pour les SOCs induits par la risperidone. A cause d’un nombre insuffisant d’essais, les investigations spécifiques d’autres AP2G n’ont pas été possibles. Toutes les études inclues avaient les données suivantes, si possible :
- Caractéristiques de la population étudiée incluant les diagnostics psychiatriques, l’âge, le sexe, le statut patient hospitalisé/ambulatoire
- L’information sur le traitement incluant la durée, la dose, la concentration sérique
- Les paramètres de conception de l’étude incluant la méthode de collecte des données, la taille d’échantillon, l’utilisation de groupes de comparaison
- Les résultats en termes de SOCs avec prévalence et évaluation de la sévérité.
Épidémiologie des SOC dans la schizophrénie
Les études épidémiologiques rapportent qu’approximativement 25 à 64 % des patients schizophréniques souffrent de SOCs, parmi lesquels 8 à 26 % satisfont aux critères cliniques significatifs du trouble obsessionnel compulsif du suivant le Manuel Diagnostic et Statistique des Troubles Mentaux (DSM) (6 à 14). Malgré des ratios variables, la majorité des études ont évalué le TOC en utilisant des méthodes d’évaluation comparables, dont la Structural Clinical Interview pour les Troubles de l’Axe I du DSM (SCID), ou la Mini-International Neuropsychiatric Interview (MINI), en association avec la Yale-Brown Obsessive Compulsive Scale (Y-BOCS). Pour tenter de comprendre l’hétérogénéité des ratios au travers des études épidémiologiques, une méta-analyse de Achim et al. (15) a examiné les taux groupés de prévalence de troubles anxieux dans la schizophrénie, pour isoler un taux moyen de 12,1 % de troubles obsessionnels compulsifs. De manière similaire, une méta-analyse combinée à une méta-régression plus récente par Swets et al. (16) a isolé des prévalences moyennes de 13,6 % pour le TOC et de 30,3 % pour les SOC dans la schizophrénie. Ces valeurs sont supérieures à celles observées dans la population générale où la prévalence sur la vie des TOC et SOCs sont respectivement de 0,3 à 3 % et de 21 à 25 %. (17 à 22).
Le risque plus élevé de comorbidité SOC dans la schizophrénie pourrait être la conséquence d’un dysfonctionnement neurobiologique similaire, en particulier dans le lobe frontal et les noyaux gris centraux pour à la fois la schizophrénie et les TOCs (23 à 25). Toutefois, seuls 1,7 à 14 % des personnes souffrant de TOC présentent des symptômes psychotiques, dont 4 à 12 % ont une schizophrénie comorbide (21, 26, 27). D’autres théories proposent que les SOCs fassent partie de la pathologie schizophrénique. Toutefois, les SOCs comorbides ne sont pas toujours observés dans le cours des troubles schizophréniques, en étant plus importants dans la schizophrénie chronique ou à un stade avancé. De même, les prévalences estimées chez les patients prodromiques ou en premier épisode sont faibles, de l’ordre de 9 % pour les SOC et 1,5 % pour le TOC (28, 29). La faible incidence des SOCs et TOC dans la schizophrénie au stade précoce pourrait résulter de l’absence de traitement psychotrope préexistant ou d’un traitement de courte durée. Bien que le terrain de cette comorbidité doive encore être clairement établi, les résultats épidémiologiques suggèrent que les antipsychotiques peuvent contribuer au risque de SOCs dans la schizophrénie.
7. Eisen JL, Beer DA, Pato MT, Venditto TA, Rasmussen SA. Obsessive-compulsive disorder in patients with schizophrenia or schizoaffective disorder. Am J Psychiatry. 1997;154(2):271–3.
8. Owashi T, Ota A, Otsubo T, Susa Y, Kamijima K. Obsessivecompulsive disorder and obsessive-compulsive symptoms in Japanese inpatients with chronic schizophrenia - a possible schizophrenic subtype. Psychiatry Res. 2010;179(3):241–6. doi:10.1016/j.psychres.2009.08.003.
9. Kayahan B, Ozturk O, Veznedaroglu B, Eraslan D. Obsessive compulsive symptoms in schizophrenia: prevalance and clinical correlates. Psychiatry Clin Neurosci. 2005;59(3):291–5. doi:10. 1111/j.1440-1819.2005.01373.x.
10. Nechmad A, Ratzoni G, Poyurovsky M, Meged S, Avidan G, Fuchs C, et al. Obsessive-compulsive disorder in adolescent schizophrenia patients. Am J Psychiatry. 2003;160(5):1002–4.
11. PoyuroskyM, Hramenkov S, Isakov V, Rauchverger B,Modai I, Schneidman M, et al. Obsessive-compulsive disorder in hospitalized patients with chronic schizophrenia. Psychiatry Res. 2001;102(1):49–57.
12. Tibbo P, Kroetsch M, Chue P, Warneke L. Obsessive-compulsive disorder in schizophrenia. J Psychiatr Res. 2000;34(2):139–46.
13. Jaydeokar S, Gore Y, Diwan P, Deshpande P, Desai N. Obsessivecompulsive symptoms in chronic schizophrenia: a new idea or an old belief? Indian J Psychiatry. 1997;39(4):324–8.
14. Berman I, Kalinowski A, Berman SM, Lengua J, Green AI. Obsessive and compulsive symptoms in chronic schizophrenia. Compr Psychiatry. 1995;36(1):6–10.
15. Achim AM, Maziade M, Raymond E, Olivier D, Merette C, Roy MA. How prevalent are anxiety disorders in schizophrenia? A meta-analysis and critical review on a significant association. Schizophr Bull. 2011;37(4):811–21. doi:10.1093/schbul/sbp148.
16. Swets M, Dekker J, van Emmerik-van Oortmerssen K, Smid GE, Smit F, de Haan L, et al. The obsessive compulsive spectrum in schizophrenia, a meta-analysis and meta-regression exploring prevalence rates. Schizophr Res. 2014;152(2-3):458–68. doi:10.10
16/j. schres.2013.10.033. A comprehensive up-to-date meta-analysis and meta-regression of 43 studies that identified adjusted mean rates of 13.6%for OCD and 30.3%for OCS in patients with schizophrenia.
17. FullanaMA,Mataix-Cols D, Caspi A, Harrington H, Grisham JR, Moffitt TE, et al. Obsessions and compulsions in the community: prevalence, interference, help-seeking, developmental stability, and co-occurring psychiatric conditions. Am J Psychiatry. 2009;166(3):329–36. doi:10.1176/appi.ajp.2008.08071006.
18. El-Sayegh S, Bea S, Agelopoulos A. Obsessive-compulsive disorder: unearthing a hidden problem. Cleve Clin J Med. 2003;70(10):824–5. 9-30, 32-3, passim.
19. Fireman B, Koran LM, Leventhal JL, Jacobson A. The prevalence of clinically recognized obsessive-compulsive disorder in a large health maintenance organization. Am J Psychiatry. 2001;158(11): 1904–10.
20. Stein MB, Forde DR, Anderson G, Walker JR. Obsessivecompulsive disorder in the community: an epidemiologic survey with clinical reappraisal. Am J Psychiatry. 1997;154( 8 ):1120–6. 510, Page 12 of 17 Curr Psychiatry Rep (2014) 16:510
21. Karno M, Golding JM, Sorenson SB, Burnam MA. The epidemiology of obsessive-compulsive disorder in five US communities. Arch Gen Psychiatry. 1988;45(12):1094–9.
22. RuscioAM, SteinDJ, ChiuWT,Kessler RC. The epidemiology of obsessive-compulsive disorder in the National Comorbidity Survey Replication. Mol Psychiatry. 2010;15(1):53–63. doi:10. 1038/mp.2008.94.
23. Cavallaro R, Cavedini P, Mistretta P, Bassi T, Angelone SM, Ubbiali A, et al. Basal-corticofrontal circuits in schizophrenia and obsessive-compulsive disorder: a controlled, double dissociation study. Biol Psychiatry. 2003;54(4):437–43.
24. Abbruzzese M, Bellodi L, Ferri S, Scarone S. Frontal lobe dysfunction in schizophrenia and obsessive-compulsive disorder: a neuropsychological study. Brain Cogn. 1995;27(2):202–12. doi:10.1006/brcg.1995.1017.
25. Tibbo P, Warneke L. Obsessive-compulsive disorder in schizophrenia: epidemiologic and biologic overlap. J Psychiatry Neurosci JPN. 1999;24(1):15–24.
26. de Haan L, Dudek-Hodge C, Verhoeven Y, Denys D. Prevalence of psychotic disorders in patients with obsessive-compulsive disorder. CNS Spectrums. 2009;14( 8 ):415–7.
27. Eisen JL, Rasmussen SA. Obsessive compulsive disorder with psychotic features. J Clin Psychiatry. 993;54(10):373–9.
28. Sterk B, Lankreijer K, Linszen DH, de Haan L. Obsessive–compulsive symptoms in first episode psychosis and in subjects at ultra high risk for developing psychosis; onset and relationship to psychotic symptoms. Aust N Z J Psychiatry. 2011;45(5):400–6. doi:10.3109/00048674.2010.533363.
29. Shioiri T, Shinada K, Kuwabara H, Someya T. Early prodromal symptoms and diagnoses before first psychotic episode in 219 inpatients with schizophrenia. Psychiatry Clin Neurosci. 2007;61(4):348–54. doi:10.1111/j.1440-1819.2007.01685.x.
Présentation clinique des SOC dans la schizophrénie
Les signes cliniques des SOC et TOC
Les SOC sont caractérisés par deux critères cliniques principaux : les obsessions et les compulsions.
Les obsessions sont des pensées, images, doutes ou urgences envahissantes, d’une nature persistante et récurrente que provoque une anxiété significative (30). Les pensées obsessionnelles portent en général sur des thèmes comme la contamination, l’agression, le perfectionnisme, le blasphème, la sexualité (31, 32). Les patients tentent d’ignorer ou de supprimer ces préoccupations ou de les neutraliser par des compulsions. Les patients ont souvent conscience de la nature de leurs obsessions, et montrent qu’ils comprennent que le contenu de leurs pensées est déraisonnable ou excessif (30).
Les compulsions sont des comportements ou des rituels mentaux répétitifs, comme le nettoyage ou le lavage de mains excessif, le comptage, l’amassement, le rangement ou la vérification, que les patients se sentent obligés de faire en réponse aux obsessions (30, 33, 34). Les SOCS sont considérés comme cliniquement sous le seuil jusqu’à ce que les symptômes prennent un temps significatif (plus d’une heure par jour) et/ou qu’ils altèrent le fonctionnement ou perturbent au point de devoir mériter le seuil de diagnostic du TOC (35).
Comparaison clinique entre TOC et schizophrénie.
TOC et schizophrénie peuvent souvent être cliniquement différenciés en distinguant les obsessions et les délires qui, bien qu’ils soient tous deux des troubles de la pensée, sont fondamentalement différents dans leur contenu et dans leur structure (voir tableau 1). Dans la schizophrénie, les délires sont des croyances erronées que les patients tiennent pour véritables malgré l’existence d’une évidente contradiction, dans la plupart des cas. De ce fait, les patients délirants défendent leurs croyances, et ne veulent pas en changer ou accepter d’autres perspectives (36 38). Le contenu du délire est souvent bizarre et, bien qu’il soit la plupart du temps de persécution ou de référence, peut être somatique, religieux, ou de grandeur (39). Les patients avec schizophrénie perçoivent aussi leurs pensées comme provenant d’une source extérieure (40). Ceci diffère des obsessions qui sont comparativement plus réalistes dans leur contenu. Les patients TOC pensent que ces obsessions sont le produit de leur esprit, et typiquement on de l’insight (ou reconnaissent que ces pensées sont irrationnelles ou exagérées), et essayent souvent de leur résister du fait de leur irrationalité ou de leur nature excessive (30, 35,41).
| Obsessions | Délires | |
| Degré de conviction | Faible | Elevé |
| Résistance au changement | Faible | Elevée |
| Contenu des pensées | Exagérée, irréaliste | Souvent bizarre |
| Origine perçue des pensées | Interne | Externe |
| Tableau 1 : différences cliniques entre obessions et délires | ||
Malgré la nature clinique différente du TOC et de la schizophrénie, il peut y avoir un certain degré de recouvrement entre ces phénotypes diagnostiques qui ajoute à l’hétérogénéité de ces troubles, cliniquement. Par exemple, bien que les patients avec un TOC sont traditionnellement définis comme gardant conscience à la fois de l’absurdité et/ou de l’origine de leurs obsessions et compulsions, un sous-type a été identifié où cet insight est déficient. Ce manque de conscience, appelé TOC avec peu de prise de conscience, conduit à un état délirant ou à la sur-justification des comportements (42 à 44). Dans les cas où les symptômes psychotiques sont plus marqués, comme lorsque le TOC primaire est accompagné d’un trouble psychotique caractérisé comme la schizophrénie, le trouble schizo-affectif ou le trouble délirant, les compulsions peuvent même être réalisées en réponse aux idées délirantes (42). De même, la schizophrénie peut être vécue avec des signes obsessionnels-compulsifs, que ce soit un TOC pleinement caractérisé ou des SOCs sous le seuil de diagnostic. Cette constellation de symptômes a été cliniquement nommée trouble schizo-affectif (45). La frontière clinique entre le TOC et la schizophrénie crée un spectre de phénotypes où le pronostic est d’autant plus pessimiste que le recouvrement des comorbidités est important (voir fig. 1)
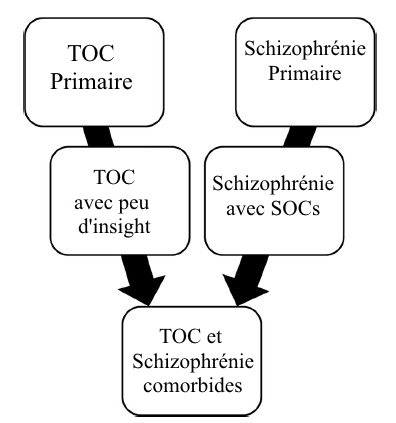 Fig 1 : différents phénotypes cliniques existent entre la schizophrénie et le trouble obsessionnel-compulsif (TOC). Le pronostic est aggravé lorsque l’on prend la direction de la comorbidité entre TOC et schizophrénie, où la détérioration clinique et l’altération du fonctionnement sont les plus grands.
Fig 1 : différents phénotypes cliniques existent entre la schizophrénie et le trouble obsessionnel-compulsif (TOC). Le pronostic est aggravé lorsque l’on prend la direction de la comorbidité entre TOC et schizophrénie, où la détérioration clinique et l’altération du fonctionnement sont les plus grands.31. Heyman I, Mataix-Cols D, Fineberg NA. Obsessive-compulsive disorder. BMJ. 2006;333(7565):424–9. doi:10.1136/bmj.333.7565. 424.
32. Stein DJ. Obsessive-compulsive disorder. Lancet. 2002;360(9330):397–405. doi:10.1016/S0140-6736(02)09620-4.
33. Bokor G, Anderson PD. Obsessive-compulsive disorder. J Pharm Pract. 2014;27(2):116–30. doi:10.1177/0897190014521996.
34. Thomsen PH. Obsessive-compulsive disorders. Eur Child Adolesc Psychiatry. 2013;22 Suppl 1:S23–8. doi:10.1007/s00787-012-0357-7.
35. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 5th ed. Arlington: American Psychiatric Publishing; 2013.
36. So SH, Freeman D, Dunn G, Kapur S, Kuipers E, Bebbington P, et al. Jumping to conclusions, a lack of belief flexibility and delusional conviction in psychosis: a longitudinal investigation of the structure, frequency, and relatedness of reasoning biases. J Abnorm Psychol. 2012;121(1):129–39. doi:10.1037/a0025297.
37. Garety PA, Freeman D, Jolley S, Dunn G, Bebbington PE, Fowler DG, et al. Reasoning, emotions, and delusional conviction in psychosis. J Abnorm Psychol. 2005;114(3):373–84. doi:10.
1037/0021-843X.114.3.373.
38. Appelbaum PS, Robbins PC, Vesselinov R. Persistence and stability of delusions over time. Compr Psychiatry. 2004;45(5):317–24. doi:10.1016/j.comppsych.2004.06.001.
39. Appelbaum PS, Robbins PC, Roth LH. Dimensional approach to delusions: comparison across types and diagnoses. Am J Psychiatry. 1999;156(12):1938–43.
40. Gold I, Hohwy J. Rationality and schizophrenic delusion. Mind Lang. 2000;15(1):146–67.
41. Bottas A, Cooke RG, Richter MA. Comorbidity and pathophysiology of obsessive-compulsive disorder in schizophrenia: is there evidence for a schizo-obsessive subtype of schizophrenia? J Psychiatry Neurosci JPN. 2005;30(3):187–93.
42. Eisen JLP, Katherine A, Rasmussen SA. Obsessions and delusions: the relationship between obsessive-compulsive disorder and the psychotic disorders. Psychiatr Ann. 1999;29(9):515–22.
43. Tumkaya S, Karadag F, Oguzhanoglu NK, Tekkanat C, Varma G, Ozdel O, et al. Schizophrenia with obsessive-compulsive disorder and obsessive-compulsive disorder with poor insight: a neuropsychological comparison. Psychiatry Res. 2009;165(1–2):38–46. doi:10.1016/j.psychres.2007.07.031.
44. Matsunaga H, Kiriike N,Matsui T, Oya K, Iwasaki Y, Koshimune K, et al. Obsessive-compulsive disorder with poor insight. Compr Psychiatry. 2002;43(2):150–7.
45. Cunill R, Castells X. Schizo-obsessive disorder. In: Ritsner MS, editor. Handbook of schizophrenia spectrum disorders: phenotypic and endophenotypic presentations. Dordrecht: Springer; 2011.
Pronostic des SOCs dans la schizophrénie
Les SOC dans la schizophrénie modifient le cours du trouble, comme on le voit dans les changements spécifiques de pronostic. Dans quelques études, il a été avancé que la comorbidité des SOCs était protectrice contre les symptômes positifs et négatifs, en particulier avec les patients d’un premier épisode (12, 46, 47). Toutefois, la majorité des chiffres plaide pour un avenir aggravé. La plupart des études ont relevé que les patients schizophréniques avec une comorbidité de SOCs connaissent des taux plus élevés de symptômes positifs (9, 48, 51) et négatifs (10, 48, 51, 52), un âge plus faible d’apparition de la psychose (53), une durée de maladie plus longue (53), l’utilisation de plus de traitements cliniques (52), et des hospitalisations plus longues et plus fréquentes (14, 52) comparés aux patients sans cette comorbidité. Les patients comorbides-SOC ont aussi de plus grandes difficultés dans leurs fonctions motrices (6, 54) et cognitives, ces dernières se présentant par une performance neurocognitive plus faible dans les tâches d’exécution (51, 52, 53), les capacités spatio-visuelles, une mémoire non verbale en retard, l’inhibition des impulsions, des décalages cognitifs (56, 57). De plus, des comorbidités psychiatriques plus larges se produisent avec les SOC dans la schizophrénie, particulièrement des taux plus élevés de troubles de l’Axe II (58), le trouble de dysmorphophobie, des troubles de tics (59, 60), l’idéation suicidaire et les tentatives de suicide (61, 62), les humeurs négatives et dépressives (9, 50, 51, 61) avec parfois la sévérité des dépressions majeures (63). Il a été montré que ces évolutions délétères causent un plus grand dysfonctionnement en terme de repli social (9), et de moins bons niveaux de fonctionnement (11, 63) dans le mariage ou la cohabitation (14), la vie indépendante, l’emploi, le comportement normal pour l’âge (9, 14, 42, 49, 52). En résumé, les conséquences cliniques et fonctionnelles des SOCs comorbides à la schizophrénie sont élevées.
Les mécanismes de SOCs induits par les antipsychotiques de seconde génération dans la schizophrénie
Facteurs de risque socio-démographiques des SOCs induits par les AP2G
Les SOCs induits par les AP2G ont été associés à certains facteurs de risque dans les études cliniques. Une revue de 28 études de cas par Ke et Al. (64) a trouvé une plus grande incidence des SOCs induits par les AP2G chez les hommes par rapport aux femmes, avec un ratio de 6 pour 1. Parmi ces cas, malgré un panel d’âges de 19 à 56 ans, la plupart des patients avaient entre 20 et 40 ans. Toutefois, le petit nombre de cas étudiés ne permet pas d’en tirer des conclusions. A l’opposé, les études d’expérimentation, ou essais, n’ont pratiquement trouvé aucune différence pour les patients schizophréniques avec ou sans SOC/TOC induits par les AP2G entre variables socio-démographiques telles que l’âge, le sexe, l’ethnie, l’éducation ou l’histoire familiale (48, 53, 54, 65).
Modèles génétiques des SOC induits par les AP2G
La schizophrénie et les TOC sont tous deux fortement héréditaires et sont des maladies polygéniques complexes (66 à 69)(a). A ce jour, divers gènes candidats impliqués dans les systèmes sérotoninergiques, dopaminergiques et glutamatergiques ont, à la fois individuellement et en synergie, été impliqués dans le risque de TOC. En particulier, les études des gènes candidats ont identifié l’implication de multiples variants génétiques des gènes liés au système sérotoninergique comme le 5-HTTLPR (région polymorphique liée au transport de la sérotonine) et HTR2A (récepteurs sérotonine 2A) dans le TOC. Des variants des gènes codant le catechol-O-methyltransferase (COMT) et la monoamine oxydase A (MAOA) ont été associés au TOC dans certains cas. Les gènes glutamatergique SLC1A1 (exciteur de transport des acides aminés 3) ont été impliqués dans les études d’association et de liens, et il y a une possibilité limitée pour un lien aux gènes dopaminergiques DAT1 (transporteur actif de dopamine) et DRD3 (récepteur de dopamine D3) dans ce phénotype. Pour plus de détails sur les bases génétiques du TOC, se référer à Pauls et al (68).
Certains de ces mêmes gènes ont été impliqués dans le risque spécifique pour les SOC/TOC induits par les psychotropes, d’après les études préliminaires sur les gènes candidats. Ryu et al. (70) ont étudié SLC1A1, avec le gène glutamatergique DLGAP3 (protéine associée 3 à grand disque), pour cette combinaison chez les patients schizophrènes cliniquement stables. Les résultats ont montré que DLGAP3 rs7525948 interagit avec SLC1A1 rs2228622 pour prédire significativement des SOC émergent sous AP2G, les porteurs de chaque génotype à risque ayant une augmentation de 30.2 du risque dans la susceptibilité SOC, comparés aux patients sans risque génotype. Un modèle épistatique similaire a été testé parmi des patients schizophréniques traités par la clozapine, par Cai et al. (65). Les résultats on révélé que SLC1A1 rs 2228622A interagissait aussi avec l’allèle GRIN2B rs890T ce qui prédisait des SOCs. Pour finir, Kwon et al. (71) ont caractérisé plus encore ce phénotype en examinant les variations de séquence dans le gène SCL1A1 chez des patients schizophrènes coréens. Les résultats ont montré que la probabilité de présenter des SOC induits par les AP2G était 4 fois plus élevée chez les patients avec l’haplotype A/C/G à rs2228622-rs3780413-rs3780412 que les patients avec l’haplotype de référence. Les tendances individuelles de l’association ont été aussi observées pour rs2228622 et rs3780412. Toutefois, Shirmbeck et al. (72) n’ont pas pu répliquer ces découvertes lors de tests sur un échantillon européen. Ceci pourrait suggérer que, bien que SCL1A1 soit une hypothèse de risque génétique pour les SOCs induits par les AP2G, ses effets peuvent différer selon les groupes ethniques. Des études plus approfondies par hypothèse ou sans hypothèse sur le génome entier, d’associations (GWAS – genome wide association studies), en plus d’études sur la fonction des gènes, sont nécessaires pour discerner plus clairement les bases génétiques des SOCs induits par les AP2G.
47. Poyurovsky M, Fuchs C, Weizman A. Obsessive-compulsive disorder in patients with first-episode schizophrenia. Am J
Psychiatry. 1999;156(12):1998–2000.
48. Sa AR, Hounie AG, Sampaio AS, Arrais J, Miguel EC, Elkis H. Obsessive-compulsive symptoms and disorder in patients with
schizophrenia treated with clozapine or haloperidol. Compr Psychiatry. 2009;50(5):437–42. doi:10.1016/j.comppsych.2008.
11.005.
49. Tiryaki A,Ozkorumak E. Do the obsessive-compulsive symptoms have an effect in schizophrenia? Compr Psychiatry. 2010;51(4):357–62. doi:10.1016/j.comppsych.2009.10.007.
50. Ongur D, Goff DC. Obsessive-compulsive symptoms in schizophrenia: associated clinical features, cognitive function and medication status. Schizophr Res. 2005;75(2–3):349–62. doi:10.1016/j.schres.2004.08.012.
51. Lysaker PH, Marks KA, Picone JB, Rollins AL, Fastenau PS, Bond GR. Obsessive and compulsive symptoms in schizophrenia:
clinical and neurocognitive correlates. J Nerv Ment Dis. 2000;188(2):78–83.
52. Hwang MY, Morgan JE, Losconzcy MF. Clinical and neuropsychological profiles of obsessive-compulsive schizophrenia: a pilot
study. J Neuropsychiatry Clin Neurosci. 2000;12(1):91–4.
53. Scheltema Beduin AA, Swets M, Machielsen M, Korver N. Obsessive-compulsive symptoms in patients with schizophrenia:
a naturalistic cross-sectional study comparing treatment with clozapine, olanzapine, risperidone, and no antipsychotics in 543
patients. J Clin Psychiatry. 2012;73(11):1395–402. doi:10.4088/JCP.11m07164.
54. Mukhopadhaya K, Krishnaiah R, Taye T, Nigam A, Bailey AJ, Sivakumaran T, et al. Obsessive-compulsive disorder in UK
clozapine-treated schizophrenia and schizoaffective disorder: a cause for clinical concern. J Psychopharmacol. 2009;23(1):6–13. doi:10.1177/0269881108089582.
55. Lysaker PH, Bryson GJ, Marks KA, Greig TC, Bell MD. Association of obsessions and compulsions in schizophrenia with
neurocognition and negative symptoms. J Neuropsychiatry Clin Neurosci. 2002;14(4):449–53.
56. Berman I, Merson A, Viegner B, Losonczy MF, Pappas D, Green AI. Obsessions and compulsions as a distinct cluster of symptoms in schizophrenia: a neuropsychological study. J Nerv Ment Dis. 1998;186(3):150–6.
57. Schirmbeck F, Esslinger C, Rausch F, Englisch S, Meyer-Lindenberg A, Zink M. Antiserotonergic antipsychotics are associated with obsessive-compulsive symptoms in schizophrenia. Psychol Med. 2011;41(11):2361–73. doi :10.1017/
S0033291711000419. Curr Psychiatry Rep (2014) 16:510 Page 13 of 17, 510
58. Rajkumar RP, Reddy YC, Kandavel T. Clinical profile of "schizoobsessive" disorder: a comparative study. Compr Psychiatry.
2008;49(3):262–8. doi:10.1016/j.comppsych.2007.09.006.
59. Poyurovsky M, Faragian S, Shabeta A, Kosov A. Comparison of clinical characteristics, co-morbidity and pharmacotherapy in adolescent schizophrenia patients with and without obsessivecompulsive disorder. Psychiatry Res. 2008;159(1–2):133–9. doi:10.1016/j.psychres.2007.06.010.
60. Poyurovsky M, Fuchs C, Faragian S, Kriss V, Weisman G, Pashinian A, et al. Preferential aggregation of obsessivecompulsive
spectrum disorders in schizophrenia patients with obsessive-compulsive disorder. Can J Psychiatry. 2006;51(12):746–54.
61. Hagen K, Hansen B, Joa I, Larsen TK. Prevalence and clinical characteristics of patients with obsessive-compulsive disorder in first-episode psychosis. BMC Psychiatry. 2013;13:156. doi:10. 1186/1471-244X-13-156.
62. Sevincok L, Akoglu A, Kokcu F. Suicidality in schizophrenic patients with and without obsessive-compulsive disorder.
Schizophr Res. 2007;90(1–3):198–202. doi:10.1016/j.schres. 2006.09.023.
63. de Haan L, Sterk B,Wouters L, Linszen DH. The 5-year course of obsessive-compulsive symptoms and obsessive-compulsive disorder in first-episode schizophrenia and related disorders. Schizophr Bull. 2013;39(1):151–60. doi:10.1093/schbul/sbr077.
64. Ke CL, Yen CF, Chen CC, Yang SJ, Chung W, Yang MJ. Obsessive-compulsive symptoms associated with clozapine and
risperidone treatment: three case reports and review of the literature. Kaohsiung J Med Sci. 2004;20(6):295–301. doi:10.1016/S1607-551X(09)70121-4.
65. Cai J, Zhang W, Yi Z, Lu W, Wu Z, Chen J, et al. Influence of polymorphisms in genes SLC1A1, GRIN2B, and GRIK2 on
clozapine-induced obsessive-compulsive symptoms. Psychopharmacology. 2013;230(1):49–55. doi:10.1007/s00213-
013-3137-2. In this genetic study, SLC1A1 and GRIN2B variants were found to increase risk and severity of OCS among
schizophrenia patients treated with clozapine, an antiserotonergic antipsychotic most strongly implicated in treatment-emergent OCS.
66. Ripke S, O'Dushlaine C, Chambert K, Moran JL, Kahler AK, Akterin S, et al. Genome-wide association analysis identifies 13
new risk loci for schizophrenia. Nat Genet. 2013;45(10):1150–9. doi:10.1038/ng.2742.
67. Cardno AG, Marshall EJ, Coid B, Macdonald AM, Ribchester TR,Davies NJ, et al.Heritability estimates for psychotic disorders:
the Maudsley twin psychosis series. Arch Gen Psychiatry. 1999;56(2):162–8.
68. Pauls DL, Abramovitch A, Rauch SL, Geller DA. Obsessivecompulsive disorder: an integrative genetic and neurobiological
perspective. Nat Rev Neurosci. 2014;15(6):410–24. doi:10.1038/nrn3746.
69. Nicolini H, Arnold P, Nestadt G, Lanzagorta N, Kennedy JL. Overview of genetics and obsessive-compulsive disorder.
Psychiatry Res. 2009;170(1):7–14. doi:10.1016/j.psychres.2008. 10.011.
70. Ryu S, Oh S, Cho EY, Nam HJ, Yoo JH, Park T, et al. Interaction between genetic variants of DLGAP3 and SLC1A1 affecting the risk of atypical antipsychotics-induced obsessive-compulsive symptoms. Am J Med Genet B Neuropsychiatr Genet Off Publ
Int Soc Psychiatr Genet. 2011;156B( 8 ):949–59. doi:10.1002/ ajmg.b.31242.
71. Kwon JS, Joo YH, Nam HJ, Lim M, Cho EY, Jung MH, et al. Association of the glutamate transporter gene SLC1A1 with atypical antipsychotics-induced obsessive-compulsive symptoms.
Arch Gen Psychiatry. 2009;66(11):1233–41. doi:10.1001/ archgenpsychiatry.2009.155.
72.Schirmbeck F, Nieratschker V, Frank J, Englisch S, Rausch F, Meyer-Lindenberg A, et al. Polymorphisms in the glutamate
transporter gene SLC1A1 and obsessive-compulsive symptoms induced by second-generation antipsychotic agents. Psychiatr
G e n e t . 2012 ; 2 2 ( 5 ) : 2 4 5 – 5 2 . d o i : 1 0 . 1 0 9 7 / Y P G . 0b013e328353fbee. A replication study of Kwon et al. (2009)
La dérégulation des neurotransmetteurs dans l’hypothèse sérotoninergique des SOCs induits par les AP2G
Le dérèglement central de sérotonine (5HT) a été fortement impliqué dans la physiopathologie du TOC. Plusieurs études rapportent un déficit de sérotonine dans des régions spécifiques du cerveau, en même temps que des niveaux périphériques élevés de métabolites 5HT, dans les modèles tant cliniques que précliniques du TOC (73 74). Le rôle du système sérotoninergique est encore mieux défendu par l’effet thérapeutique des inhibiteurs sélectifs de la recapture de sérotonine (ISRS/SSRIs) dans le TOC en normalisant des niveaux aberrants de sérotonine (73 75 76). Les ISRS, tels que la fluvoxamine (ndt: Floxyfral@) et la fluoxétine (ndt: Prozac@), réalisent cet effet en bloquant la recapture 5HT dans les neurones présynaptiques en agissant sur le site du transporteur de sérotonine (77, 78) pour augmenter la disponibilité synaptique 5HT et faciliter la liaison post-synaptique (79) (voir fig 2a). On a également rapporté que les ISRS/SSRI réduisent le turn-over 5HT comme démontré par des niveaux cérébro-spinaux du métabolite central 5-acide hydroxyindoleacetiqu (5-HIAA) (79).
Des effets sérotoninergiques similaires ont été observés pour des antidépresseurs tricycliques comme la clomipramine (ndt: Anafranil@), et diminution des plaquettes et de la concentration sanguine 5HT a été une hypothèse émise pour la réduction de la symptomatologie TOC (80). L’altération d’autres neurotransmetteurs, comme la dopamine (81, 82) et le glutamate (83) ont aussi été impliqués dans la neurobiologie du TOC, mais le mécanisme exact de leurs effets n’est pas bien compris. Ainsi, alors que différents systèmes neurotransmetteurs sont altérés pendant le traitement antipsychotique, l’antagonisme sérotoninergique de la plupart des AP2G apparaît être le mécanisme le plus probable impliqué dans les SOCs induits par les AP2G. Ceci est décrit plus en détail ci-après.

a. l’ISRS (en vert) bloque la recapture de la sérotonine (en violet) dans la terminaison nerveuse présynaptique. Ceci a pour effet une augmentation de la sérotonine 5HT dans l’espace inter-synaptique et d’augmenter les liaisons post-synaptiques.
b. L’AP2G, comme la clozapine et l’olanzapine (en bleu) empêche la sérotonine de se lier à ses récepteurs (en rouge) ce qui diminue la liaison 5HT.
Les propriétés pharmacodynamiques des AP2G et les SOCs
Les médicaments antipsychotiques, qui globalement comprennent les AP1G - première génération et les AP2G - deuxième génération, sont conçus pharmacologiquement pour agir en antagonistes des récepteurs de dopamine D2. Cette propriété, en particulier dans la voie mésolimbique, est la principale responsable de l’effet antipsychotique de ces produits. Malgré leur similarité, les AP2G sont pharmacologiquement distincts des AP1G définis par la force de leur de leur blocage des récepteurs D2, ainsi que par leur antagonisme unique de du récepteur de sérotonine 5HT2A (fig 2b) (84). La plupart des AP2G obtiennent leur réponse antipsychotique par leur occupation préférentielle des 5HT2 par rapport aux récepteurs D2, comme observé in vitro et in vivo (85, 86). Kapur et al. (85) on montré que la clozapine (ndt: Leponex@), l’olanzapine (ndt: Zyprexa@) et la rispéridone (ndt: Risperdal@) ont une affinité 5HT2 plus grande que pour D2, d’après leur taux d’occupation de 20 :1, 12 :1 et 11 :1. Des profils pharmacodynamiques similaires ont été observés pour la ziprazidone (ndt: Zeldo@, Geodon@) (87) et la quetiapine (ndt: Xeroquel@, Seroquel@)( 88 ). Toutefois, l’aripiprazole (ndt: Apilify@) est différemment caractérisée par une occupation plus faible 5HT2 par rapport à D2 (89). Néanmoins, les AP2G peuvent montrer un lien D2 augmenté lorsque administrés à des doses plus fortes (90, 91). Les AP2G se dissocient aussi rapidement du récepteur D2 lorsqu’ils sont en compétition avec la dopamine endogène (92). Ceci les différencie des AP1G dopaminergiques qui ont comparativement un moindre taux de dissociation dans ces sites (93).
Le profil de lien antisérotoninergique ds AP2G est le mécanisme supposé par lequel ces psychotropes induisent et exacerbent les SOCs. Cette théorie est soutenue par de multiples axes de recherche et de découvertes. En premier, Ma et al. (94) ont découvert que l’antagonisme du système 5HT induit par la clozapine altérait les niveaux de sérotonine à des niveaux comparables au TOC. En second, les SOCs induits par les AP2G sont souvent réduits par une pharmacothérapie d’appoint avec des ISRS/SSRI, traditionnellement prescrits pour traiter les TOCs (53). Enfin, les études des traitements aux AP1G ont montré que les agents à dominante dopaminergique comme l’halopéridol (ndt: Haldol@), produisaient une prévalence et une sévérité estimée différente de celle des AP2Gs (48). Par exemple, les AP2G n’on habituellement aucun effet ou améliorent les symptômes TOC et peuvent être co-administrés avec des ISRS/SSRI pour améliorer des TOC résistants au traitement (95, 96). Les mêmes bénéfices ont été observés avec les AP2G à dominante dopaminergique comme l’amisulpride (ndt: Solian@) (97), et l’agoniste dopamine/serotonine partiel aripiprazole (98 à 100). Bien que d’autres AP2G prototypiques comme la clozapine, l’olanzapine, la risperidone et la quetiapine aient, dans certains cas, montré une capacité d’amélioration des SOCs à la fois dans le TOC primaire (101 à 103) et la schizophrénie (104 105), ceci peut être la conséquence d’une dose élevée qui, comme précédemment mentionné, élève les affinités aux récepteurs D2. Le paragraphe suivant résumera les preuves des effets des AP2G dans les SOCs et TOC induits par les psychotropes.
73. Aouizerate B, Guehl D, Cuny E, Rougier A, Burbaud P, Tignol J, et al. Updated overview of the putative role of the serotoninergic system in obsessive-compulsive disorder. Neuropsychiatr DisTreat. 2005;1(3):231–43.
74. Charney DS, Goodman WK, Price LH, Woods SW, Rasmussen SA, Heninger GR. Serotonin function in obsessive-compulsive disorder. A comparison of the effects of tryptophan and mchlorophenylpiperazine in patients and healthy subjects. Arch Gen Psychiatry. 1988;45(2):177–85.
75. Pogarell O, Hamann C, Pöpperl G, Juckel G, Choukèr M, Zaudig M, et al. Elevated brain serotonin transporter availability in patients with obsessive-compulsive disorder. Biol Psychiatry. 2003;54(12):1406–13. doi:10.1016/s0006-3223(03)00183-5.
76. Barr LC, Goodman WK, Price LH. The serotonin hypothesis of obsessive compulsive disorder. Int Clin Psychopharmacol 1993;8 Suppl 2:79–82.
77. Billett EA, Richter MA, King N, Heils A, Lesch KP, Kennedy JL. Obsessive compulsive disorder, response to serotonin reuptake inhibitors and the serotonin transporter gene. Mol Psychiatry.1997;2(5):403–6.
78. Hanna GL, Himle JA, Curtis GC, Koram DQ, Veenstra-VanderWeele J, Leventhal BL, et al. Serotonin transporter and seasonal variation in blood serotonin in families with obsessivecompulsive disorder. Neuropsychopharmacol Off Publ Am Coll Neuropsychopharmacol. 1998;18(2):102–11. doi:10.1016/S0893-133X(97)00097-3.
79. Zohar J, Mueller EA, Insel TR, Zohar-Kadouch RC, Murphy DL. Serotonergic responsivity in obsessive-compulsive disorder. Comparison of patients and healthy controls. Arch Gen Psychiatry. 1987;44(11):946–51.
80. Hanna GL, Yuwiler A, Cantwell DP. Whole blood serotonin during clomipramine treatment of juvenile obsessive-compulsive disorder. J Child Adolesc Psychopharmacol. 1993;3(4):223–9.
81. Koo MS, Kim EJ, Roh D, Kim CH. Role of dopamine in the pathophysiology and treatment of obsessive-compulsive disorder. Expert Rev Neurother. 2010;10(2):275–90. doi:10.1586/ern.09.148.
82. Goodman WK, McDougle CJ, Price LH, Riddle MA, Pauls DL, Leckman JF. Beyond the serotonin hypothesis: a role for dopamine in some forms of obsessive compulsive disorder? J Clin Psychiatry. 1990;51(Suppl):36–43. discussion 55-8.
83. Pittenger C, Bloch MH, Williams K. Glutamate abnormalities in obsessive compulsive disorder: neurobiology, pathophysiology, and treatment. Pharmacol Ther. 2011;132(3):314–32. doi:10.1016/j.pharmthera.2011.09.006.
84. Stahl SM. Antipsychotic Agents. Stahl's Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. 3rd ed. New York: Cambridge University Press;2008.
85. Kapur S, Zipursky RB, Remington G. Clinical and theoretical implications of 5-HT2 and D2 receptor occupancy of clozapine, risperidone, and olanzapine in schizophrenia. Am J Psychiatry. 1999;156(2):286–93.
86. Meltzer HY, Huang M. In vivo actions of atypical antipsychotic drug on serotonergic and dopaminergic systems. Prog Brain Res. 2008;172:177–97. doi:10.1016/S0079-6123(08)00909-6. 510, Page 14 of 17 Curr Psychiatry Rep (2014) 16:510
87. Mamo D, Kapur S, Shammi CM, Papatheodorou G, Mann S, Therrien F, et al. A PET study of dopamine D2 and serotonin 5-HT2 receptor occupancy in patients with schizophrenia treated with therapeutic doses of ziprasidone. Am J Psychiatry. 2004;161(5):818–25.
88. Kapur S, Zipursky R, Jones C, Shammi CS, Remington G, Seeman P. A positron emission tomography study of quetiapine in schizophrenia: a preliminary finding of an antipsychotic effect with only transiently high dopamine D2 receptor occupancy. Arch Gen Psychiatry. 2000;57(6):553–9.
89. Mamo D, Graff A, Mizrahi R, Shammi CM, Romeyer F, Kapur S. Differential effects of aripiprazole on D(2), 5-HT(2), and 5-HT(1A) receptor occupancy in patients with schizophrenia: a triple tracer PET study. Am J Psychiatry. 2007;164(9):1411–7. doi:10.1176/appi.ajp.2007.06091479.
90. Kapur S, Zipursky RB, Remington G, Jones C, DaSilva J,Wilson AA, et al. 5-HT2 and D2 receptor occupancy of olanzapine in schizophrenia: a PET investigation. Am J Psychiatry. 1998;155(7):921–8.
91. Nyberg S, Eriksson B, Oxenstierna G, Halldin C, Farde L. Suggested minimal effective dose of risperidone based on PET measured D2 and 5-HT2A receptor occupancy in schizophrenic patients. Am J Psychiatry. 1999;156(6):869–75.
92. Stahl SM. Describing an atypical antipsychotic: receptor binding and its role in pathophysiology. Prim Care Companion J Clin Psychiatry. 2003;5 suppl 3:9–13. 93. Kapur S, Seeman P. Does fast dissociation fromthe dopamine d(2) receptor explain the action of atypical antipsychotics?: a new hypothesis. Am J Psychiatr. 2001;158(3):360–9.
94. Ma N, Tan LW, Wang Q, Li ZX, Li LJ. Lower levels of whole blood serotonin in obsessive-compulsive disorder and in schizophrenia with obsessive-compulsive symptoms. Psychiatry Res. 2007;150(1):61–9. doi:10.1016/j.psychres.2005.10.005.
95. McDougle CJ, Goodman WK, Leckman JF, Lee NC, Heninger GR, Price LH. Haloperidol addition in fluvoxamine-refractory obsessive-compulsive disorder. A double-blind, placebocontrolled study in patients with and without tics. Arch Gen Psychiatry. 1994;51(4):302–8.
96. O'Regan JB. Treatment of obsessive–compulsive neurosis with haloperidol. Can Med Assoc J. 1970;103(2):167–8. 97. Kim SW, Shin IS, Kim JM, Yang SJ, Hwang MY, Yoon JS. Amisulpride improves obsessive-compulsive symptoms in schizophrenia patients taking atypical antipsychotics: an open-label switch study. J Clin Psychopharmacol. 2008;28(3):349–52. doi: 10.1097/JCP.0b013e318172755a.
98. Yang KC, Su TP, Chou YH. Effectiveness of aripiprazole in treating obsessive compulsive symptoms. Prog Neuro-Psychopharmacol Biol Psychiatry. 2008;32(2):585–6. doi:10.1016/j.pnpbp.2007.10.009.
99. Connor KM, PayneVM, Gadde KM, ZhangW, Davidson JR. The use of aripiprazole in obsessive-compulsive disorder: preliminary observations in 8 patients. J Clin Psychiatry. 2005;66(1):49–51.
100. Eryilmaz G, Hizli Sayar G, Ozten E, Gogcegoz Gul I, Karamustafalioglu O. Aripirazole augmentation in clozapine associated obsessive-compulsive symptoms in schizophrenia.Ann Gen Psychiatry. 2013;12(1):40. doi:10.1186/1744-859X-12-40.
101. Skapinakis P, Papatheodorou T, Mavreas V. Antipsychotic augmentation of serotonergic antidepressants in treatment-resistant obsessive-compulsive disorder: a meta-analysis of the randomized controlled trials. Eur Neuropsychopharmacol J Eur Coll Neuropsychopharmacol. 2007;17(2):79–93. doi:10.1016/j.euroneuro.2006.07.002.
102. Dold M, Aigner M, Lanzenberger R, Kasper S. Antipsychotic augmentation of serotonin reuptake inhibitors in reatment resistant obsessive-compulsive disorder: a meta-analysis of double-blind, randomized, placebo-controlled trials. Int J Neuropsychopharmacol. 2013;16(3):557–74. doi:10.1017/S1461145712000740.
103. Sareen J, Kirshner A, Lander M, Kjernisted KD, Eleff MK, Reiss JP. Do antipsychotics ameliorate or exacerbate obsessive compulsive disorder symptoms? a systematic review. J Affect Disord. 2004;82(2):167–74. doi:10.1016/j.jad.2004.03.011.
104. Tibbo P, Gendemann K. Improvement of obsessions and compulsions with clozapine in an individual with schizophrenia. Can J Psychiatry. 1999;44(10):1049–50.
105. Poyurovsky M, Dorfman-Etrog P, Hermesh H, Munitz H, Tollefson GD, Weizman A. Beneficial effect of olanzapine in schizophrenic patients with obsessive-compulsive symptoms. Int Clin Psychopharmacol. 2000;15(3):169–73.
74. Charney DS, Goodman WK, Price LH, Woods SW, Rasmussen SA, Heninger GR. Serotonin function in obsessive-compulsive disorder. A comparison of the effects of tryptophan and mchlorophenylpiperazine in patients and healthy subjects. Arch Gen Psychiatry. 1988;45(2):177–85.
75. Pogarell O, Hamann C, Pöpperl G, Juckel G, Choukèr M, Zaudig M, et al. Elevated brain serotonin transporter availability in patients with obsessive-compulsive disorder. Biol Psychiatry. 2003;54(12):1406–13. doi:10.1016/s0006-3223(03)00183-5.
76. Barr LC, Goodman WK, Price LH. The serotonin hypothesis of obsessive compulsive disorder. Int Clin Psychopharmacol 1993;8 Suppl 2:79–82.
77. Billett EA, Richter MA, King N, Heils A, Lesch KP, Kennedy JL. Obsessive compulsive disorder, response to serotonin reuptake inhibitors and the serotonin transporter gene. Mol Psychiatry.1997;2(5):403–6.
78. Hanna GL, Himle JA, Curtis GC, Koram DQ, Veenstra-VanderWeele J, Leventhal BL, et al. Serotonin transporter and seasonal variation in blood serotonin in families with obsessivecompulsive disorder. Neuropsychopharmacol Off Publ Am Coll Neuropsychopharmacol. 1998;18(2):102–11. doi:10.1016/S0893-133X(97)00097-3.
79. Zohar J, Mueller EA, Insel TR, Zohar-Kadouch RC, Murphy DL. Serotonergic responsivity in obsessive-compulsive disorder. Comparison of patients and healthy controls. Arch Gen Psychiatry. 1987;44(11):946–51.
80. Hanna GL, Yuwiler A, Cantwell DP. Whole blood serotonin during clomipramine treatment of juvenile obsessive-compulsive disorder. J Child Adolesc Psychopharmacol. 1993;3(4):223–9.
81. Koo MS, Kim EJ, Roh D, Kim CH. Role of dopamine in the pathophysiology and treatment of obsessive-compulsive disorder. Expert Rev Neurother. 2010;10(2):275–90. doi:10.1586/ern.09.148.
82. Goodman WK, McDougle CJ, Price LH, Riddle MA, Pauls DL, Leckman JF. Beyond the serotonin hypothesis: a role for dopamine in some forms of obsessive compulsive disorder? J Clin Psychiatry. 1990;51(Suppl):36–43. discussion 55-8.
83. Pittenger C, Bloch MH, Williams K. Glutamate abnormalities in obsessive compulsive disorder: neurobiology, pathophysiology, and treatment. Pharmacol Ther. 2011;132(3):314–32. doi:10.1016/j.pharmthera.2011.09.006.
84. Stahl SM. Antipsychotic Agents. Stahl's Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. 3rd ed. New York: Cambridge University Press;2008.
85. Kapur S, Zipursky RB, Remington G. Clinical and theoretical implications of 5-HT2 and D2 receptor occupancy of clozapine, risperidone, and olanzapine in schizophrenia. Am J Psychiatry. 1999;156(2):286–93.
86. Meltzer HY, Huang M. In vivo actions of atypical antipsychotic drug on serotonergic and dopaminergic systems. Prog Brain Res. 2008;172:177–97. doi:10.1016/S0079-6123(08)00909-6. 510, Page 14 of 17 Curr Psychiatry Rep (2014) 16:510
87. Mamo D, Kapur S, Shammi CM, Papatheodorou G, Mann S, Therrien F, et al. A PET study of dopamine D2 and serotonin 5-HT2 receptor occupancy in patients with schizophrenia treated with therapeutic doses of ziprasidone. Am J Psychiatry. 2004;161(5):818–25.
88. Kapur S, Zipursky R, Jones C, Shammi CS, Remington G, Seeman P. A positron emission tomography study of quetiapine in schizophrenia: a preliminary finding of an antipsychotic effect with only transiently high dopamine D2 receptor occupancy. Arch Gen Psychiatry. 2000;57(6):553–9.
89. Mamo D, Graff A, Mizrahi R, Shammi CM, Romeyer F, Kapur S. Differential effects of aripiprazole on D(2), 5-HT(2), and 5-HT(1A) receptor occupancy in patients with schizophrenia: a triple tracer PET study. Am J Psychiatry. 2007;164(9):1411–7. doi:10.1176/appi.ajp.2007.06091479.
90. Kapur S, Zipursky RB, Remington G, Jones C, DaSilva J,Wilson AA, et al. 5-HT2 and D2 receptor occupancy of olanzapine in schizophrenia: a PET investigation. Am J Psychiatry. 1998;155(7):921–8.
91. Nyberg S, Eriksson B, Oxenstierna G, Halldin C, Farde L. Suggested minimal effective dose of risperidone based on PET measured D2 and 5-HT2A receptor occupancy in schizophrenic patients. Am J Psychiatry. 1999;156(6):869–75.
92. Stahl SM. Describing an atypical antipsychotic: receptor binding and its role in pathophysiology. Prim Care Companion J Clin Psychiatry. 2003;5 suppl 3:9–13. 93. Kapur S, Seeman P. Does fast dissociation fromthe dopamine d(2) receptor explain the action of atypical antipsychotics?: a new hypothesis. Am J Psychiatr. 2001;158(3):360–9.
94. Ma N, Tan LW, Wang Q, Li ZX, Li LJ. Lower levels of whole blood serotonin in obsessive-compulsive disorder and in schizophrenia with obsessive-compulsive symptoms. Psychiatry Res. 2007;150(1):61–9. doi:10.1016/j.psychres.2005.10.005.
95. McDougle CJ, Goodman WK, Leckman JF, Lee NC, Heninger GR, Price LH. Haloperidol addition in fluvoxamine-refractory obsessive-compulsive disorder. A double-blind, placebocontrolled study in patients with and without tics. Arch Gen Psychiatry. 1994;51(4):302–8.
96. O'Regan JB. Treatment of obsessive–compulsive neurosis with haloperidol. Can Med Assoc J. 1970;103(2):167–8. 97. Kim SW, Shin IS, Kim JM, Yang SJ, Hwang MY, Yoon JS. Amisulpride improves obsessive-compulsive symptoms in schizophrenia patients taking atypical antipsychotics: an open-label switch study. J Clin Psychopharmacol. 2008;28(3):349–52. doi: 10.1097/JCP.0b013e318172755a.
98. Yang KC, Su TP, Chou YH. Effectiveness of aripiprazole in treating obsessive compulsive symptoms. Prog Neuro-Psychopharmacol Biol Psychiatry. 2008;32(2):585–6. doi:10.1016/j.pnpbp.2007.10.009.
99. Connor KM, PayneVM, Gadde KM, ZhangW, Davidson JR. The use of aripiprazole in obsessive-compulsive disorder: preliminary observations in 8 patients. J Clin Psychiatry. 2005;66(1):49–51.
100. Eryilmaz G, Hizli Sayar G, Ozten E, Gogcegoz Gul I, Karamustafalioglu O. Aripirazole augmentation in clozapine associated obsessive-compulsive symptoms in schizophrenia.Ann Gen Psychiatry. 2013;12(1):40. doi:10.1186/1744-859X-12-40.
101. Skapinakis P, Papatheodorou T, Mavreas V. Antipsychotic augmentation of serotonergic antidepressants in treatment-resistant obsessive-compulsive disorder: a meta-analysis of the randomized controlled trials. Eur Neuropsychopharmacol J Eur Coll Neuropsychopharmacol. 2007;17(2):79–93. doi:10.1016/j.euroneuro.2006.07.002.
102. Dold M, Aigner M, Lanzenberger R, Kasper S. Antipsychotic augmentation of serotonin reuptake inhibitors in reatment resistant obsessive-compulsive disorder: a meta-analysis of double-blind, randomized, placebo-controlled trials. Int J Neuropsychopharmacol. 2013;16(3):557–74. doi:10.1017/S1461145712000740.
103. Sareen J, Kirshner A, Lander M, Kjernisted KD, Eleff MK, Reiss JP. Do antipsychotics ameliorate or exacerbate obsessive compulsive disorder symptoms? a systematic review. J Affect Disord. 2004;82(2):167–74. doi:10.1016/j.jad.2004.03.011.
104. Tibbo P, Gendemann K. Improvement of obsessions and compulsions with clozapine in an individual with schizophrenia. Can J Psychiatry. 1999;44(10):1049–50.
105. Poyurovsky M, Dorfman-Etrog P, Hermesh H, Munitz H, Tollefson GD, Weizman A. Beneficial effect of olanzapine in schizophrenic patients with obsessive-compulsive symptoms. Int Clin Psychopharmacol. 2000;15(3):169–73.