Seroplex : le cadeau de 814 millions d'euros de la France au laboratoire Lundbeck
Historique
Le Seroplex (escitalopram) - est, depuis 2002, commercialisé par le laboratoire danois Lundbeck principalement comme antidépresseur. Il est aujourd’hui l’antidépresseur de type ISRS (1) le plus vendu en France, et est devenu à son tour générique en 2014.
L’escitalopram (Seroplex) est un énantiomère du citalopram (Seropram@), ce qui signifie que le citalopram (Seropram) contient du S-citalopram (ou "escitalopram" - Seroplex) et du R-citalopram qui sont deux versions géométriques de la même molécule. Le Seropram@ est l’ancien antidépresseur de Lundbeck lancé en 1995 et devenu générique en 2003. De ce fait, Seroplex et Seropram sont le même médicament, comme l'indique même le laboratoire pour justifier l'absence de recherches toxicologiques effectuées pour la version "Seroplex".
Les associations d’usagers, de médecins indépendants (Formindep, Prescrire), et même les laboratoires concurrents ont dénoncé le fait que Lundbeck ait obtenu une autorisation de vendre le Seroplex car il n’apporte aucune amélioration par rapport à son précédent antidépresseur, le Seropram, et qu’il repose sur la même molécule active. De plus, l’ANSM a confirmé en 2008, et confirme encore aujourd’hui, qu’il n’apporte aucune amélioration par rapport aux autres antidépresseurs (2), et ce, dans aucune des indications pour lesquelles il est vendu.
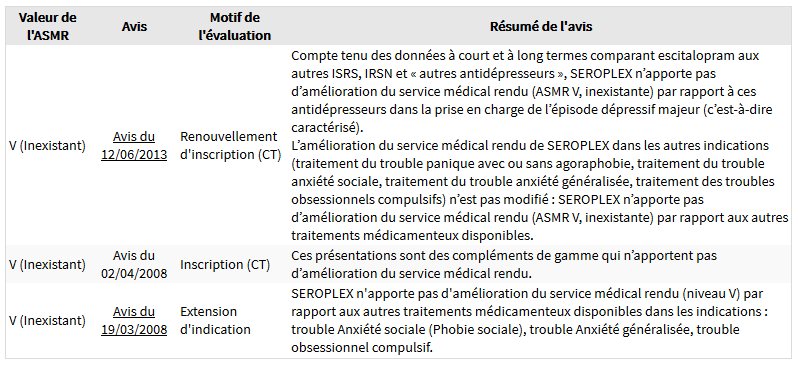
La qualification de l'ANSM concernant le Seroplex - escitalopram : amélioration inexistante par rapport aux autres médicaments disponibles, dont le Seropram@, et ce, dans toutes les indications (2).
Il est aussi confirmé dans cette notice officielle que l’escitalopram (Seroplex) a les mêmes effets toxiques que son précurseur le citalopram (Seropram).
Le laboratoire Lundbeck, a économisé des millions en recherche : « Les études précliniques classiques complètes n’ont pas été réalisées avec l’escitalopram du fait que les études toxicocinétiques et toxicologiques conduites chez le rat avec l’escitalopram et le citalopram ont montré des résultats similaires. De ce fait, les données obtenues avec le citalopram peuvent être extrapolées à l’escitalopram. » (2)
L’industrie pharmaceutique ne cesse de justifier les prix élevés des nouveaux médicaments par « le coût énorme de la recherche et du développement, des essais etc. ». Pour le Seroplex, Lundbeck n'a fait aucune recherche, et très peu d'essais puisqu'ils étaient déjà faits - et largement amortis - avec le Seropram.
Par contre, les dépenses en marketing direct (visites aux médecins avec invitations, hôtels, séminaires, dons et partenariats avec diverses associations) ont été conséquentes, et représentent 20% du prix de la boîte. Le bénéfice n'en reste pas moins excessif et injustifié.
Une commission de la transparence... très opaque
En dépit de toute logique, et en pleine contradiction avec ses écrits, la "commission de la transparence" de la Haute Autorisé de Santé (HAS), composée d'anonymes "experts", a approuvé la commercialisation au prix fort, et fut suivie par l'ANSM. Aucune explication rationnelle ne permet de justifier cette décision de l'ANSM, et donc toutes les suspicions sont permises. Seule une enquête judiciaire permettrait de savoir la vérité, et éventuellement de réparer le préjudice économique causé à notre pays par quelques personnes.
L'histoire continue : le lancement du Brintellix (vortioxétine) en 2015 coïncide également avec le passage en générique du Seroplex (escitalopram). On n'a plus besoin de démontrer que Lundbeck se soucie davantage de ses marges, que de mettre au point des molécules innovantes. La commission juge encore une fois, à propos du Brintellix, que ce produit n'apporte lui non plus aucune « amélioration du service rendu » par rapport aux produits existants, mais recommande sa commercialisation et son remboursement.
Et sur ce constat et malgré les erreurs du passé, l'ANSM autorise encore la commercialisation du Brintellix, pour 30 euros la boîte, tout en abaissant le taux de remboursement à 30%.

La qualification de l'ANSM concernant le Brintellix - vortioxétine : amélioration inexistante par rapport aux autres médicaments disponibles (3).

Comme les produits concurrents ou précédents de la même catégorie, le Brintellix - vortioxétine - apporte peu dans l’absolu (3).
Sommaire
- I. Seroplex : le cadeau de 814 millions du gouvernement français au laboratoire Lundbeck
- II. Efficacité du Seroplex et du Seropram (escitalopram) sur le trouble dépressif majeur - en préparation
- III. Effets indésirables ou secondaires du Seroplex / Seropram (escitalopram) - en préparation
- IV. Sevrage et effets secondaires persistants - en préparation
(1) ISRS : inibiteurs sélectifs de la recapture de la sérotonine. Dans cette catégorie on trouve le Prozac (fluoxétine), le Deroxat (paroxétine), et une dizaine de produits moins connus. cf : liste des antidépresseurs par catégorie
(2) Agence Nationale de la Sécurité des produits de Santé et des Médicaments (ANSM), autorité délivrant les autorisations de mise sur le marché (AMM) en France - Fiche officielle du Seroplex
(3) Agence Nationale de la Sécurité des produits de Santé et des Médicaments (ANSM) - Fiche officielle du Brintellix (vortioxétine)
(4) Statistiques "Ameli" de l'Assurance Maladie, France
814 millions d'euros pour rien
Les chiffres de l'assurance maladie française (CPAM) concernant les remboursements des antidépresseurs successifs de Lundbeck et de leurs génériques, sont parlants.

Remboursements par l'assurance maladie en France d'antidépresseurs Lundbeck, et génériques - 2002-2017. Source : chiffres CPAM (4), analyse Neptune
Le simple fait de vendre sous forme de Seroplex à 22 € la boîte entre 2005 et 2013 (prix auquel aurait pu prétendre un produit innovant), alors que le même produit, Seropram, était vendu en marque ou en générique au prix de 15 €, génère une dépense inutile pour l'état de (22-15)/15 fois le chiffre des remboursements de Seroplex, soit 22-15/15 x 1 133 200 000 euros = 529 millions d'euros.
Les patients, en contribuant à ces achats pour 35% ont, eux, versé la somme excessive de 529 000 000 x 35/65 = 249 millions d'euros, en ne faisant que présenter l'ordonnance fournie par leur médecin ou psychiatre.
Au total, le cadeau fait à Lundbeck qui n'a que très peu dépensé en recherche et développement pour le seul Seroplex, est donc de 814 millions d'euros.
A titre de comparaison, la baisse de 5 euros des allocations logement pour les plus démunis (APL), fait économiser 390 millions d’euros à l’état. La taxe sur le diesel qui a provoqué le mouvement des "gilets jaunes" aurait pu être épargnée aux ménages les plus pauvres avec une seule décision correcte sur un seul psychotrope.
Au surplus, nous n'avons pas chiffré ici le coût de prescription inadapté de ce produit par les médecins et psychiatres ne suivant pas les recommandations de la Haute Autorité de Santé : plus de 30% des antidépresseurs sont en effet prescrits à des personnes ne souffrant pas de dépression majeure ni d'aucun trouble pour lesquels ces produits sont indiqués. L'addition se chiffre alors en milliards d'euros, sans compter les effets iatrogènes de ces produits et leur coût sociétal effarant. Les articles du présent chapitre reviennent en effet sur la notion de bénéfice / risque global des antidépresseurs, et de chaque antidépresseur.
Conclusion
S'il n'est plus permis de douter de la stratégie du laboratoire Lundbeck, dont l'objectif prioritaire est d'abord d'engranger un maximum de bénéfices, il est par contre permis d'avoir des doutes sur l'impartialité des décisions de l'opaque "commission de la transparence" de la HAS qui, en France, approuve ou désapprouve la commercialisation des médicaments, ainsi que de l'ANSM, qui prend la décision finale et fixe le prix de vente et le taux de remboursement.
Il existe des raisons d'espérer qu'il y ait moins d'aberrations économiques et médicales dans le domaine des psychotropes. En effet, prises entre plusieurs feux, l'ANSM commence a freiner la dérive de commercialisation d'antidépresseurs sans valeur ajoutée, et, si elle a encore autorisé le Brintellix en 2015, n'a permis son remboursement qu'à hauteur de 30%.
Une décision non médicale donc, mais purement politico-budgétaire, ménageant les puissants que sont l'État et ses demandes d'économies, Lundbeck, et à faire payer au final le patient. Autrement dit "ce produit est inutile, doit être surveillé, mais nous l'autorisons pour une dépense de 30 euros dont nous prenons 30% à notre charge". Quitte à culpabiliser les patients et médecins qui prendront ou prescriront ce produit autorisé ? On ne connaitra peut-être jamais les tenants d'une telle décision.
Il devient nécessaire de publier la composition nominative de ces instances, et d'en exclure tout personne ayant des liens d'intérêt avec un laboratoire pharmaceutique, ou ayant des objectifs d'économies budgétaires non affichés. Il n'est pas normal que ce soient des associations citoyennes qui doivent éplucher chaque décision pour faire la part des choses entre le rationnel et l'économico-politique.
Neptune



